Konfigurasi Elektron Gas Mulia adalah cara untuk menggambarkan atom dalam hal jumlah elektron yang terdapat pada kulit atom. Dalam kimia, konfigurasi elektronik ini merupakan salah satu konsep dasar yang sangat penting untuk dipahami, sebab memungkinkan kita mempelajari sifat-sifat senyawa, dan cara-cara yang digunakan untuk membuat ikatan kimia. Seperti halnya memahami entalpi, entropi atau tingkat reaksi, memahami konfigurasi elektron Gas Mulia sangat penting untuk memahami bagaimana atom menumbuhkan ikatan satu sama lain dalam senyawa kimia.
Definisi Konfigurasi Elektron Gas Mulia
Konfigurasi Elektron Gas Mulia adalah konfigurasi elektron yang sangat stabil untuk atom-atom, karena kulit atau lapisan terluar sudah terisi penuh dengan elektron. Sebagai kelompok, Gas Mulia atau Noble Gas, yaitu Helium (He), Neon (Ne), Argon (Ar), Kripton (Kr), Xenon (Xe) dan Radon (Rn), adalah unsur-unsur kimia yang paling stabil karena mereka memiliki orbit elektron terluar yang sudah terisi penuh. Karenanya, konfigurasi elektron gas mulia sangat penting dalam ilmu kimia.
Pentingnya Memahami Konfigurasi Elektron Gas Mulia
Memahami konfigurasi elektron Gas Mulia adalah penting karena membantu kita memprediksi sifat dan perilaku atom ketika berada dalam bentuk unsur atau dalam bentuk senyawa. Konfigurasi elektron dari suatu atom diketahui dengan cara menulis jumlah elektron di setiap kulit dan subkulit di dalam notasi elektron. konfigurasi elektron gas mulia merupakan konfigurasi yang sangat stabil untuk atom-atom karena kulit/kelopak terluar sudah terisi penuh dengan elektron.
Konfigurasi elektronik yang tidak stabil atau keadaan elektronik yang belum mencapai konfigurasi yang stabil cenderung melakukan reaksi kimia dengan atom atau molekul lain untuk mencapai konfigurasi elektronik yang stabil.
Konfigurasi elektron GAs Mulia sangat penting dalam penjelasan bagaimana molekul dan senyawa kimia terbentuk dan dalam penjelasan tentang perilaku atom ketika terjadi reaksi kimia. Karena konfigurasi elektron gas mulia adalah dasar untuk memahami bagaimana atom menumbuhkan ikatan satu sama lain dalam senyawa kimia, memahami konfigurasi ini membantu kita memahami ikatan kimia.
Konfigurasi elektron Gas Mulia dapat memenuhi duet atau oktet nya, di mana duet adalah konfigurasi elektronik yang paling stabil dari He, dan oktet adalah konfigurasi elektronik yang paling stabil dari Ne-on ke arah Z=10-18.
Dalam ilmu kimia, konsep konfigurasi elektron gas mulia juga membantu dalam memahami bagaimana senyawa dan molekul terbentuk, dan bagaimana reaksi kimia berlangsung. Oleh karena itu, memahami konfigurasi elektron Gas Mulia atau konfigurasi elektron gas mulia sangat penting bagi kita yang belajar kimia. Konfigurasi elektronik juga digunakan dalam penggambaran atom dan molekul dalam bidang fisika atom dan kimia.
Dasar-dasar Konfigurasi Elektron
Definisi Konfigurasi Elektron
Konfigurasi Elektron adalah penempatan elektron dalam kulit atom (shell) atau subkulit yang berbeda dalam atom dengan menggunakan aturan tertentu. Ini bisa diartikan sebagai model dalam struktur internal atom yang menggambarkan jumlah elektron dan penempatan mereka dalam orbital dan subkulit selama atom tersebut dalam keadaan dasar. Konfigurasi elektronik ditulis dalam bentuk subkulit elektron yang terisi dengan notasi elektron.
Pentingnya Konfigurasi Elektron dalam Kimia
Konfigurasi Elektron sangat penting dalam kimia karena menggambarkan bentuk geometris, sifat fisik, dan sifat kimia atom. Konfigurasi elektron menentukan perilaku unsur dalam senyawa kimia, termasuk ikatan kovalen, ikatan ionik, dan sifat reaktif. Konfigurasi elektron juga membantu dalam memahami sifat magnetik dari suatu atom atau senyawa kimia.
Selain itu, dalam kimia organik, konfigurasi elektron menentukan interaksi antara molekul dalam molekul kompleks dan menggambarkan efek substituen pada molekul. Konfigurasi elektron juga digunakan dalam penjelasan laju reaksi kimia dan sifat-sifat termodinamika senyawa.
Jadi, dengan memahami methode untuk menentukan konfigurasi elektron, kita dapat memprediksi perilaku unsur dalam senyawa kimia dan memprediksi sifat-sifat termodinamika dari senyawa. Konsep konfigurasi elektron juga sangat penting dalam mengembangkan fungsi material elektronik dan dalam memahami sifat-sifat dalam material kimia terkait sifat konduktivitas, kekuatan, dan elastisitasnya.
Memahami Gas Mulia
Definisi Gas Mulia
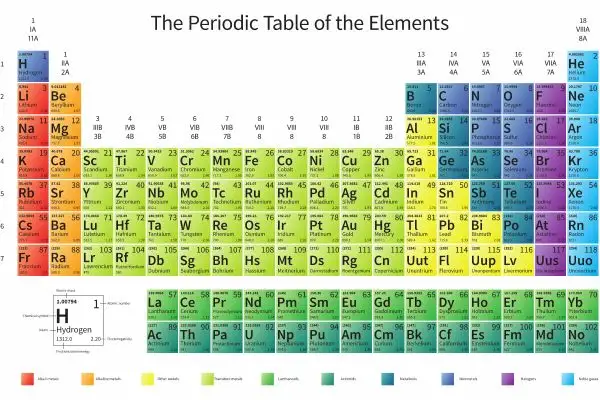
Gas Mulia atau Noble Gas adalah kelompok unsur dalam tabel periodik yang memiliki sifat-sifat yang stabil dan sangat minim terlibat dalam reaksi kimia karena mereka memiliki konfigurasi elektronik yang sangat stabil. Kelompok ini terdiri dari unsur-unsur helium (He), neon (Ne), argon (Ar), kripton (Kr), xenon (Xe), dan radon (Rn).
Sifat-sifat Gas Mulia
Gas Mulia memiliki sifat-sifat unik yang berbeda dari elemen lainnya dalam tabel periodik, antara lain:
- Mereka memiliki konfigurasi elektronik terluar yang sangat stabil dengan oktet elektron penuh, membuatnya sulit untuk terikat pada atom lain.
- Mereka bersifat inaktif secara kimia, artinya mereka sulit bereaksi dengan unsur lain dan biasanya ditemukan sebagai unsur murni di alam.
- Mereka memiliki titik didih dan titik leleh yang sangat rendah, dan memerlukan energi yang sangat tinggi untuk diionisasi.
- Mereka memiliki sifat non-logam dan dapat digunakan sebagai jenis gas pendingin dalam berbagai aplikasi, seperti pengisian sirkuit elektronik.
Contoh Gas Mulia
Contoh Gas Mulia adalah:
- Helium (He)
- Neon (Ne)
- Argon (Ar)
- Kripton (Kr)
- Xenon (Xe)
- Radon (Rn)
Helium terdapat dalam gas alam dan sering digunakan dalam pemberian oksigen dan dalam pengembangan teknologi termal. Neon dapat digunakan dalam pencahayaan, dan argon digunakan sebagai gas pelindung untuk melakukan pengelasan.
Kripton dan Xenon digunakan dalam pengisian lampu kilat dan dalam berbagai industri, seperti industri penerbangan untuk membuat panel instrumen pesawat terbang. Sementara Radon adalah gas radioaktif yang dihasilkan dari peluruhan uranium dan digunakan untuk mempelajari sifat fisika radioaktif.
Konfigurasi Elektron Gas Mulia

Langkah-langkah penulisan Konfigurasi Elektron Gas Mulia
Langkah-langkah penulisan Konfigurasi Elektron Gas Mulia adalah sebagai berikut:
- Tentukan unsur kimia yang akan dihitung konfigurasi elektronnya.
- Cari tahu nomor atom dari unsur kimia tersebut pada tabel periodik.
- Hitung jumlah elektron atom tersebut dengan mengacu pada nomor atom pada tabel periodik, yang menunjukkan jumlah proton dan elektron di atom.
- Tentukan urutan isian elektron kulit yang disusun berdasarkan tingkat energi terendah hingga yang tertinggi. Mulai dengan kulit 1, di mana jumlah maksimum elektron di kulit pertama hanya dua, lalu lanjutkan pada kulit berikutnya sampai pada kulit akhir.
- Isi subkulit elektron yang ada di dalam kulit-kulit tersebut sesuai dengan aturan-oktet dan aturan-duet, sedangkan subkulit elektron 5f dan 6d diabaikan dalam penulisan konfigurasi elektronik ion. Subkulit elektron yang tersedia untuk diisi adalah s, p, d dan f.
Contoh penulisan Konfigurasi Elektron Gas Mulia
Contoh penulisan Konfigurasi Elektron Gas Mulia adalah sebagai berikut:
- Helium (He): 1s2
- Neon (Ne): 1s2 2s2 2p6
- Argon (Ar): 1s2 2s2 2p6 3s2 3p6
- Kripton (Kr): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
- Xenon (Xe): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
- Radon (Rn): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6
Perhatikan bahwa ketika menambah elektron ke dalam subkulit elektron, aturan-oktet dan aturan-duet harus diikuti. Atom gas mulia yang meliputi elemen He, Ne, Ar, Kr, Xe, dan Rn, memiliki konfigurasi elektronik yang termasuk dalam kelompok sangat stabil dan tidak mudah bereaksi dengan unsur lain.
Konfigurasi elektronik ini menjelaskan sifat kimia yang khas dari elemen-elemen ini, yang digunakan dalam penjelasan tentang sifat-sifat senyawa kimia dan reaksi kimia.

Hubungan antara Gas Mulia, Elektron Valensi, dan Ikatan Kimia
Definisi Elektron Valensi
Elektron valensi adalah elektron yang ditemukan di kulit terluar suatu atom dan terlibat dalam ikatan kimia antara atom-atom, serta menentukan sifat-sifat kimia unsur itu. Elektron-valensi membentuk ikatan kimia dengan elektron valensi dari atom-atom lain untuk membentuk ikatan kovalen atau ikatan ionik.
Pentingnya Elektron Valensi dalam Ikatan Kimia
Elektron valensi sangat penting untuk memahami bagaimana ikatan kimia terbentuk. Elektron valensi menentukan sifat-sifat kimia unsur dan cara bagaimana unsur tersebut bereaksi dengan unsur lain. Unsur-unsur kimia yang memiliki konfigurasi elektron gas mulia dan elektron valensi penuh, cenderung bersifat inert dan tidak reaktif dalam ikatan kimia.
Sementara unsur yang memiliki elektron valensi yang tidak penuh, cenderung bereaksi dengan mudah dengan unsur-unsur lain untuk mencapai konfigurasi elektronik yang stabil.
Contoh Ikatan Kimia menggunakan Konfigurasi Elektron Gas Mulia
Konfigurasi Elektron Gas Mulia digunakan untuk menjelaskan bagaimana ikatan kimia terbentuk antara unsur-unsur. Dalam hal ini, unsur yang memiliki konfigurasi elektronik mirip dengan konfigurasi elektron Gas Mulia cenderung lebih mudah membentuk ikatan.
Berikut merupakan contoh ikatan kimia yang menggunakan Elektron Gas Mulia:
Ikatan Kovalen
Dalam ikatan kovalen, elektron valensi dari atom-atom berbagi, dan konfigurasi elektron gas mulia digunakan untuk menunjukkan bagaimana elektron valensi dipertukarkan. Sebagai contoh, molekul nitrogen (N2) memiliki konfigurasi elektron gas mulia 1s2 2s2 2p3, yang berarti ada tiga valensi elektron yang siap untuk berikatan. Atas dasar ini, kedua atom nitrogen berbagi tiga pasang elektron untuk membentuk molekul N2.
Ikatan Ionik
Dalam ikatan ionik, atom menyerahkan elektron valensi mereka untuk membentuk ion positif atau negatif. Konfigurasi elektron gas mulia dapat digunakan untuk menentukan bagaimana valensi- elektron transfer terjadi. Sebagai contoh, pada ion NaCl, natrium (Na) dengan konfigurasi elektron gas mulia 1s2 2s2 2p6 3s1, menyerahkan satu elektron valensinya ke klorin (Cl) dengan konfigurasi 1s2 2s2 2p6 3s2 3p5, untuk membentuk ion Na+ dan Cl- yang terikat ionik satu sama lain.
Dalam kedua contoh ini, konfigurasi elektron gas mulia dan elektron valensi membantu kita memahami proses ikatan kimia antara unsur-unsur dan bagaimana struktur molekul dapat diprediksi.
Berbagai Bentuk Gas Mulia Dalam Kimia
Isotop Gas Mulia
Isotop Gas Mulia adalah variasi dari gas mulia klasik yang dihasilkan ketika jumlah neutron di dalam inti atom gas mulia berubah. Contohnya adalah isotop Ne dengan massa 20 dan Ne dengan massa 22, yang memiliki 10 proton dan 10 dan 12 neutron masing-masing, memiliki sifat fisis dan kimia yang hampir sama dengan neon asli.
Gas Mulia Radikal
Gas Mulia Radikal, juga dikenal sebagai “radikal edelweiss”, adalah gas mulia yang berada dalam bentuk radikal, yaitu secara formal atom-atom menyimpang dari konfigurasi elektron gas mulia mereka yang stabil. Contohnya, Radikal He+, yang terbentuk setelah helium terionisasi dengan kehilangan elektron, memiliki sifat kimia yang sama dengan ion Hidrogen (H+).
Senyawa dari Gas Mulia
Pada umumnya, Gas Mulia sangat inaktif kimia dan jarang membentuk senyawa dengan unsur lain. Namun, beberapa senyawa dengan Gas Mulia telah dibuat secara artifisial melalui penggunaan kondisi ekstrem seperti sangat tinggi tekanan dan suhu yang sangat rendah. Senyawa yang dihasilkan antara lain:
- XePtF6: Senyawa Xe (xenon) pertama yang berhasil dibuat. Senyawa ini berbentuk kristal, yang terdiri dari atom Xe yang terikat pada cincin PtF6-.
- KrF2: Senyawa Kr (kripton) yang terdiri dari satu atom Kr yang terikat dengan dua atom fluorin (F) di mana kripton mempunyai bilangan oksidasi 2. Senyawa ini digunakan dalam kimia organik sebagai agen pengoksidasi yang kuat.
- ArCl2 dan KrCl2: Senyawa ini terdiri dari satu atom gas mulia dalam hubungan ikatan dengan dua atom klorin. Senyawa ini stabil di bawah suhu yang sangat rendah.
Walaupun dibuat dalam kondisi ekstrem dan bersifat sangat tidak stabil, senyawa dari Gas Mulia sangat penting dalam penelitian kimia dan fisika modern, dan menjadi dasar untuk mengembangkan fungsi material dan teknologi lainnya.
Pentingnya Gas Mulia dalam Kehidupan Kita

Pentingnya Gas Mulia dalam kehidupan sehari-hari
Gas Mulia memiliki berbagai aplikasi dalam kehidupan sehari-hari, antara lain:
- Neon (Ne) digunakan dalam signage atau tanda-tanda cahaya neon
- Helium (He) digunakan untuk mengisi balon pesta dan sebagai plasma cutting pada industri manufaktur
- Kripton (Kr) dan Xenon (Xe) digunakan dalam lampu kilat untuk fotografi dan film
- Argon (Ar) digunakan sebagai gas pelindung dalam pengelasan, pengecatan, dan pengelasan aluminium
- Radon (Rn) digunakan dalam radioterapi untuk mengobati kanker
- Gas Mulia juga digunakan dalam pengisian sirkuit elektronik, pendingin kelompok sumber daya, dan dalam aplikasi pengukuran tekanan dan kualitas lingkungan.
Tanpa adanya Gas Mulia, berbagai produk dan layanan yang kita gunakan dalam kehidupan sehari-hari tidak akan mudah ditemukan dan dilaksanakan.
Penggunaan Gas Mulia dalam bidang medis
Gas Mulia juga memiliki aplikasi dalam bidang medis, seperti:
- Neon (Ne) digunakan dalam ventilator bayi untuk membantu bayi yang baru lahir bernapas
- Helium (He) digunakan dalam terapi nebulization untuk mengobati penyakit paru-paru
- Xenon (Xe) digunakan sebagai anestesi saat operasi saraf pada otak dan trauma kepala
- Argon (Ar) digunakan dalam reseksi bedah prostate
- Kripton (Kr) digunakan sebagai ajaran gas dengan waktu paruh yang singkat dalam pengobatan kejang
- Radon (Rn) digunakan dalam terapi radiasi untuk mengobati kanker.
Penggunaan Gas Mulia dalam bidang medis terus berkembang dengan adanya penelitian dan pengembangan teknologi yang terus menerus.
Kesimpulan
Konfigurasi Elektron Gas Mulia membantu kita memahami struktur atom dan bagaimana atom terikat dengan atom lain membentuk senyawa kimia. konfigurasi elektron gas mulia sangat stabil dan menjadi dasar untuk memahami ikatan kimia. Isotop, radikal, dan senyawa gas mulia memberikan beragam informasi tentang pentingnya gas mulia dalam kimia. Selain itu, Gas Mulia juga memainkan peran penting di kehidupan sehari-hari kita, seperti dalam bidang kesehatan dan bahan bakar.
FAQs
1. Apa itu Konfigurasi Elektron Gas Mulia?
Konfigurasi Elektron Gas Mulia adalah cara untuk menggambarkan atom dalam hal jumlah elektron yang terdapat pada kulit atom.
2. Apa yang dimaksud dengan Noble Gas?
Noble Gas adalah kelompok unsur dalam tabel periodik yang terdiri dari helium (He), neon (Ne), argon (Ar), krypton (Kr), xenon (Xe), dan radon (Rn).
3. Apa yang dimaksud dengan Isotop Noble Gas?
Isotop Noble Gas adalah isotop yang mudah terbentuk melalui peluruhan radioaktif dari unsur-unsur lain.
4. Dimana Gas Mulia digunakan dalam kehidupan sehari – hari?
Gas Mulia terdapat banyak di kehidupan sehari-hari, seperti dalam bidang kesehatan dan bahan bakar.
5. Apa pentingnya mempelajari Konfigurasi Elektron Gas Mulia dalam kimia?
Mempelajari Konfigurasi Elektron Gas Mulia penting dalam kimia, karena memungkinkan kita memahami bagaimana bertautan dan bereaksi antara atom yang berbeda.